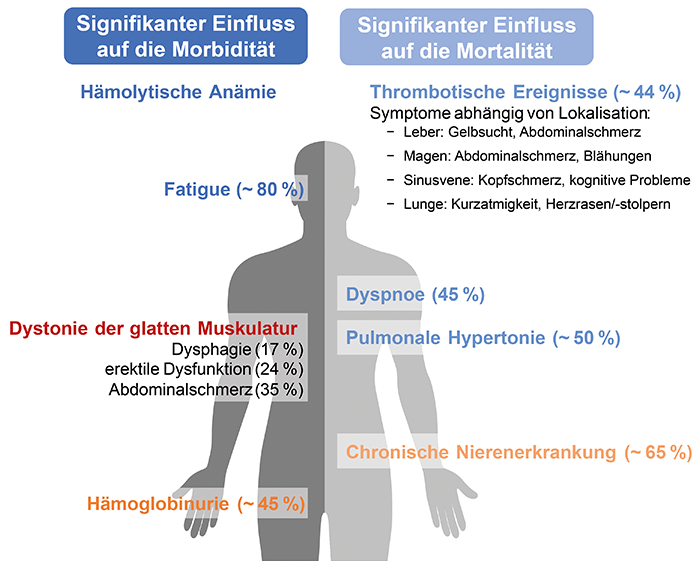
Verlauf und Symptomatik der PNH sind variabel. Einige Patient*innen haben kaum Beschwerden, andere hingegen sind schwer oder gar lebensbedrohlich krank. Auslöser der vielfältigen Symptome ist eine für die PNH charakteristische Triade klinischer Eigenschaften bestehend aus Hämolyse, Thrombosen und Knochenmarkversagen.
Hämolyse bei PNH
Das Fehlen GPI-verankerter Komplement-regulierender Proteine macht PNH-Erythrozyten besonders vulnerabel gegenüber der Komplement-vermittelten Hämolyse: Zum einen werden die PNH-Erythrozyten intravasal in den Blutgefäßen zerstört und zum anderen extravasal in Milz, Leber und Knochenmark abgebaut. Je nach Ausmaß des GPI-defizienten Erythrozyten-Klons hat dies eine mehr oder minder schwere hämolytische Anämie zur Folge. Anders als der Krankheitsname suggeriert, findet die Hämolyse weder ausschließlich paroxysmal statt, noch beschränkt sie sich auf die Nacht, sondern sie ist vielmehr ein chronisches Geschehen. Darüber hinaus können Infektionen oder eine starke körperliche Belastung, die das Komplementsystem aktivieren, hämolytische Krisen auslösen, in deren Verlauf vorhandene PNH-Erythrozyten intravaskulär lysieren. Zusätzlich kann die hämolytische Anämie durch ein Knochenmarkversagen verstärkt werden.1
Die Hämolyse-bedingten Symptome beherrschen das klinische Bild der PNH. Rund 80 % aller Patient*innen leiden unter einer ausgeprägten Fatigue, deren Schwere mit dem Ausmaß des hämolytischen Geschehens zusammenhängt.2 Des Weiteren tritt bei fast der Hälfte der Betroffenen eine Dyspnoe auf. Die namensgebende Hämoglobinurie als Zeichen des Erythrozytenzerfalls zeigt sich zum Diagnosezeitpunkt lediglich bei 45 % der PNH-Patient*innen3, wobei der Urin besonders in den Morgenstunden dunkel gefärbt ist und die Intensität im weiteren Tagesverlauf abnimmt.
Im Zuge der Hämolyse bindet das aus den zerstörten Erythrozyten freigesetzte Hämoglobin freies Stickstoffmonoxid (NO). Da NO die Thrombozytenaggregation hemmt, bewirkt ein Mangel eine erhöhte Thromboseneigung. Darüber hinaus kann die Abnahme von freiem NO zu einer Dystonie der glatten Muskulatur führen3,4 und im Zusammenspiel mit wiederkehrenden thrombotischen Episoden die Entstehung einer pulmonalen Hypertonie begünstigen, welche die Anämie-bedingte Dyspnoe noch weiter verschlimmern kann.5
Unter supportiver Therapie allein führt die PNH im Laufe der Zeit bei fast zwei Drittel der PNH-Patient*innen zu einer chronische Nierenerkrankung6, die zum einen auf Vasospasmen aufgrund des NO-Mangels und zum anderen auf Hämosiderin-Ablagerungen in den proximalen Tubuli sowie Mikrothromben zurückzuführen ist.7
Thrombosen bei PNH
Thromboembolische Ereignisse zählen zu den häufigsten Komplikationen der PNH und sind für bis zu zwei Drittel aller Todesfälle bei PNH-Patient*innen verantwortlich.8 Insbesondere bei Vorhandensein der typischen PNH-Anzeichen und -Symptome wie Hämolyse und Hämoglobinurie ist mit einem erhöhten Thromboserisiko zu rechnen. Darüber hinaus sind abdominale oder thorakale Schmerzen sowie Dyspnoe – neben einer Erhöhung der Laktatdehydrogenase – unabhängige Risikofaktoren für ein mögliches thromboembolisches Ereignis.9
Thrombosen bei PNH-Patient*innen ereignen sich sowohl venös als auch arteriell. Venenthrombosen sind bei PNH-Patient*innen insgesamt häufiger und kommen v. a. in hepatischen, viszeralen, und zerebrale Venen, aber auch in den tiefen Beinvenen vor.
Zytopenie bei PNH
Die Hämolyse und der daraus resultierende Erythrozytenmangel gehört zu den klassischen Zeichen der PNH. Neben einer Verringerung der Erythrozytenzahl können PNH-Patient*innen gleichzeitig aber auch eine Thrombozytopenie und/oder Neutropenie aufweisen. Blutungen bzw. eine erhöhte Infektanfälligkeit sind die Folge. Die PNH hat sich in diesen Fällen auf Basis einer erworbenen aplastischen Anämie entwickelt.10
Referenzen
- Hill A, et al. Paroxysmal nocturnal haemoglobinuria. Nat Rev Dis Prim 2017;3(1):17028
- Schrezenmeier H, et al. Baseline characteristics and disease burden in patients in the International Paroxysmal Nocturnal Hemoglobinuria Registry. Haematologica 2014; 99(5):922-9
- Schrezenmeier H, et al. Baseline clinical characteristics and disease burden in patients with paroxysmal nocturnal hemoglobinuria (PNH): updated analysis from the International PNH Registry. Ann Hematol 2020;99(7):1505-14
- Kelly RJ, et al. Long-term treatment with eculizumab in paroxysmal nocturnal hemoglobinuria: sustained efficacy and improved survival. Blood 2011;117(25):6786-92.
- Hill A, et al. Effect of eculizumab on haemolysis-associated nitric oxide depletion, dyspnoea, and measures of pulmonary hypertension in patients with paroxysmal nocturnal haemoglobinuria. Br J Haematol 2010;149(3):414-25
- Hillmen P, et al. Natural history of paroxysmal nocturnal hemoglobinuria. N Engl J Med 1995;333(19):1253-8
- Hillmen P, et al. Long-term effect of the complement inhibitor eculizumab on kidney function in patients with paroxysmal nocturnal hemoglobinuria. Am J Hematol 2010;85:553-9
- Sahin F, et al. Pesg PNH diagnosis, follow-up and treatment guidelines. Am J Blood Res 2016;6(2):19-27
- Lee JW, et al. Clinical signs and symptoms associated with increased risk for thrombosis in patients with paroxysmal nocturnal hemoglobinuria from a Korean Registry. Int J Hematol 2013;97(6):749-57
- Socié G, et al. Late clonal diseases of treated aplastic anemia. Semin Hematol 2000;37(1):91-101
Diagnostik

Bei Patient*innen mit Zeichen einer Anämie sollte neben einem Eisenmangel als häufigster Ursache auch an eine PNH gedacht werden. Insbesondere wenn diese von Hämoglobinurie, erhöhten Hämolyseparametern, Symptomen eines Knochenmarkversagens oder nicht erklärbaren Thrombosen begleitet werden.
Therapie
Die Therapie der PNH orientiert sich hauptsächlich am klinischen Bild. Neben supportiven Maßnahmen zur Symptomlinderung stehen außerdem Medikamente zur Verfügung, mit denen die übermäßige Komplement-Aktivierung reguliert werden soll.

