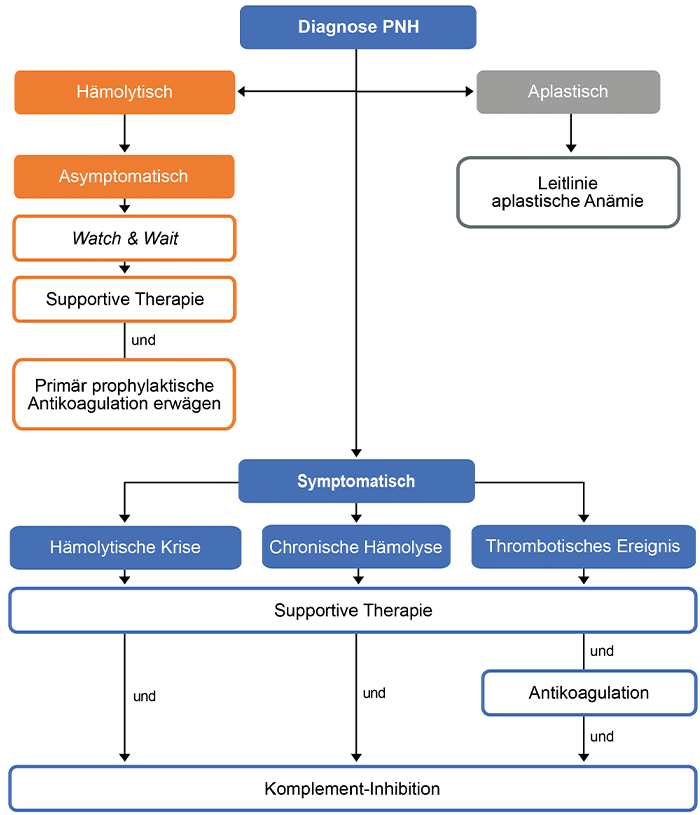
Ob und wie die PNH behandelt werden muss, hängt vom Ausmaß der Beschwerden und vom PNH-Subtyp ab. Bei einer PNH ohne nennenswerte Symptomatik ist erst einmal Watch & Wait möglich. Dies trifft oftmals auf die subklinische PNH und die PNH im Rahmen eines Knochenmarkversagen-Syndroms zu, bei denen der Fokus meist erst einmal auf der Behandlung des zugrundeliegenden Knochenmarkdefekts liegt. Im Falle der klassischen PNH steht die Kontrolle der Komplement-Aktivierung im Vordergrund, um Komplikationen vorzubeugen, Beschwerden zu lindern und die Lebensqualität der Betroffenen zu verbessern.
Die PNH ist eine chronische Erkrankung, wenngleich spontane Remissionen auftreten können. Eine medikamentöse Heilung der PNH ist bislang nicht möglich. Somit ist derzeit die allogene Stammzelltransplantation die einzige kurative Therapieoption. Da die Fünf-Jahres-Überlebensrate von PNH-Patient*innen nach Stammzelltransplantation u. a. aufgrund von Abstoßungsreaktionen oder Infektionen bei maximal 60 % liegt, kommt diese Therapieoption nur in Frage bei einer PNH im Kontext einer aplastischen Anämie sowie für Patient*innen, bei denen ein sekundäres Knochenmarkversagen droht oder die PNH in ein myelodysplastisches Syndrom oder eine akute Leukämie übergeht. Auch wenn PNH-Patient*innen, trotz prophylaktischer Antikoagulation und Komplement-Inhibition wiederholt unter thromboembolischen Ereignissen leiden, kann eine allogene Stammzelltransplantation erwogen werden. Ansonsten erfolgt die Behandlung der PNH symptomorientiert. Je nach Bedarf werden dafür die supportiven Maßnahmen durch eine Antikoagulationstherapie und/oder Medikamente zur Komplement-Inhibition ergänzt.1
Supportive Maßnahmen bei PNH
PNH-Patient*innen ohne nennenswerte Beschwerden, Transfusionsbedarf und mit unauffälligen Laborwerten bedürfen nicht zwangsläufig einer Therapie. Generell wird aber bei fast allen Betroffenen die Gabe von Folsäure empfohlen, da der übermäßige Zerfall der Erythrozyten eine kompensatorische Steigerung der Erythropoese zur Folge hat. Sofern ein entsprechender Mangel festgestellt wurde, sollte außerdem Vitamin B12 substituiert werden. Bei asymptomatischen Patient*innen mit einem erheblichen Anteil an PNH-Zellen (> 50 %), Thrombozytenzahlen > 100 x 109/l und ohne übermäßige Blutungsneigung kann eine prophylaktische Antikoagulation das Thromboserisiko reduzieren.1,2
Leiden Patient*innen unter Symptomen wie Fatigue, Schwäche oder Kurzatmigkeit wird die Transfusion von Erythrozytenkonzentraten empfohlen. Zudem wird zu einer oralen Eisen-Substitution unter Überwachung des Eisenstoffwechsels geraten, wenn wegen einer chronischen Hämoglobinurie die Gefahr eines schweren Eisenmangels besteht. Für Patient*innen nach stattgehabter Thrombose ist wegen des immanenten Rezidivrisikos eine dauerhafte Antikoagulationstherapie ratsam. In der Regel ist diese bei PHN-Patient*innen allein aber nicht ausreichend, um weitere thrombotische Ereignisse zu verhindern, weshalb zeitnah mit einer Komplement-Inhibition begonnen werden sollte.1
Wichtig ist zudem eine zügige Antibiose bakterieller Infektionen, da diese zu hämolytischen Krisen führen können.1
Immunsuppressiva sind hingegen zur Behandlung des hämolytischen Geschehens nicht geeignet, sind aber sinnvoll, wenn Symptome des Knochenmarkversagens das klinische Bild dominieren.1
Komplement-Inhibition bei PNH
Die Präsenz eines PNH-Klons an sich ist noch keine Indikation mit einer Komplement-inhibierenden Therapie zu beginnen. Anlass dazu geben aber eine klinisch relevante chronische Hämolyse, hämolytische Krisen oder Thrombosen, die häufig erst bei großen PNH-Klonen auftreten.1
Für die Komplement-Inhibition sind verschiedene monoklonale Antikörper verfügbar, die gezielt in das terminale Komplementsystem eingreifen. Indem sie den Komplementfaktor C5 binden und so dessen Spaltung hemmen, unterbinden sie die Bildung des Membranangriffskomplex und die dadurch vermittelte Lyse der Erythrozyten. Mit den C5-Komplement-Inhibitoren wird eine Kontrolle der in den Gefäßen ablaufenden intravasalen Hämolyse erreicht, das Thromboserisiko reduziert und das Gesamtüberleben verbessert.3,4-7
Eine weitere therapeutische Möglichkeit ist die Hemmung des proximalen Komplementsystems in einem der C5-Aktivierung vorgeschalteten Schritt mittels Inhibitoren von C3. Indem die proximalen Komplement-Inhibitoren die Spaltung der für die Bildung der C3-Konvertase benötigten Komponenten unterbinden, können sie die C5-vermittelte intravaskuläre Hämolyse verhindern. Da zudem weniger C3-Spaltprodukte für die Beladung und Markierung (Opsonierung) von PNH-Erythrozyten zur Verfügung stehen, kann auch die extravasale Hämolyse in Milz, Leber und Knochenmark vermieden werden.
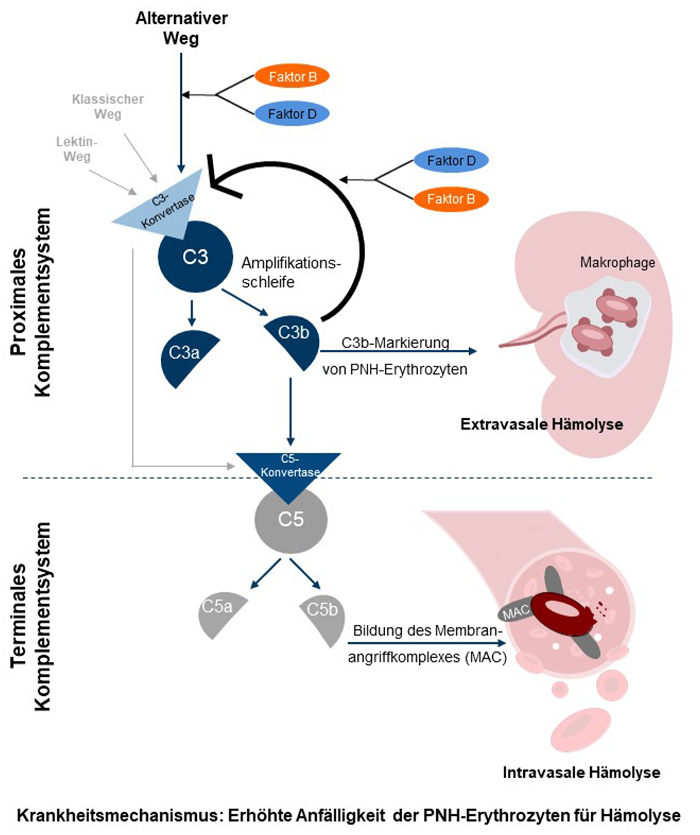
Die ungehemmte Aktivität des alternativen Komplementweges ist für die PNH ursächlich. Innerhalb dieses Weges sind Faktor B und Faktor D für die Bildung der C3-Konvertase in einer Amplifikationsschleife verantwortlich. Die übermäßige Komplementaktivität hat die intravasale Hämolyse in den Gefäßen zur Folge.
Unter Therapie mit Komplement-Inhibitoren besteht ein erhöhtes Risiko für Infektionen mit bekapselten Bakterien wie Neisseria meningitidis, Streptococcus pneumoniae und Haemophilus influenzae. Vor Beginn der Therapie mit diesen Medikamenten ist eine Überprüfung und Aktualisierung des Impfstatus obligat.
 Grenzen aktueller PNH-Therapien
Grenzen aktueller PNH-Therapien
Die Komplement-Inhibition hat die Therapie der PNH revolutioniert. Trotz Therapie wird der Alltag von vielen PNH-Patient*innen durch Hämolyse weiter beeinträchtigt. Gerade die weiter bestehende Fatigue kann die Lebensqualität der Patient*innen stark einschränken.
Referenzen
- Onkopedia-Leitlinie Paroxysmale nächtliche Hämoglobinurie. Stand März 2022. https://www.onkopedia.com/de/onkopedia/guidelines/paroxysmale-naechtlich...@@guideline/html/index.html#24; abgerufen am 05.05.2023
- Lee JW, et al. Clinical signs and symptoms associated with increased risk for thrombosis in patients with paroxysmal nocturnal hemoglobinuria from a Korean Registry. Int J Hematol 2013;97(6):749-57
- Kelly RJ, et al. Long-term treatment with eculizumab in paroxysmal nocturnal hemoglobinuria: sustained efficacy and improved survival. Blood 2011;117(25):6786-92.
- Brodsky RA, et al. Multicenter phase 3 study of the complement inhibitor eculizumab for the treatment of patients with paroxysmal nocturnal hemoglobinuria. Blood 2008;111(4):1840-7
- Hillmen P, et al. Effect of the complement inhibitor eculizumab on thromboembolism in patients with paroxysmal nocturnal hemoglobinuria. Blood 2007;110(12):4123-8
- Lee JW, et al. Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 study. Blood 2019;133(6):530-9
- Loschi M, et al. Impact of eculizumab treatment on paroxysmal nocturnal hemoglobinuria: a treatment versus no-treatment study. Am J Hematol 2016;91(4):366-70
Symptome

Das klinische Bild der Paroxysmale nächtliche Hämoglobinurie (PNH) präsentiert sich mitunter sehr variabel: Manche Betroffene sind nahezu symptomfrei, während andere ausgeprägte Beschwerden bis hin zu lebensbedrohlichen Komplikationen entwickeln.
Diagnostik

Bei Patient*innen mit Zeichen einer Anämie sollte neben einem Eisenmangel als häufigster Ursache auch an eine PNH gedacht werden. Insbesondere wenn diese von Hämoglobinurie, erhöhten Hämolyseparametern, Symptomen eines Knochenmarkversagens oder nicht erklärbaren Thrombosen begleitet werden.